摘要:免疫营养是一种对肿瘤发生发展过程中的免疫、代谢和炎症变化具有重要调节作用的靶向性营养治疗,是肿瘤营养治疗的重要分支,已在手术、放化疗及肿瘤并发症治疗等多个领域得到广泛应用。然而,虽然已有多项国际营养指南述及免疫营养素在肿瘤临床治疗中的应用,但多数仅作为指南中零散的部分,缺乏系统的整理和归纳,并且部分指南中相关内容及临床研究结果尚存在争议。此外,现阶段人们对肿瘤免疫营养素的具体作用机制和疗效等方面认识的不足,进一步导致了免疫营养在临床实践中应用的局限性和不规范性。因此,为了更好地指导临床实践,在循证医学的指引下,通过对近年来发表的重要临床研究结果和权威指南的收集和整理,中国抗癌协会肿瘤营养专业委员会专家对各种研究证据进行了系统分析和反复校对,并根据牛津循证医学中心意见分级标准的证据和推荐水平提出了严格的推荐意见,对《肿瘤免疫营养治疗指南》(2016年)予以更新,以期为临床肿瘤患者规范化的免疫营养治疗提供参考和依据。
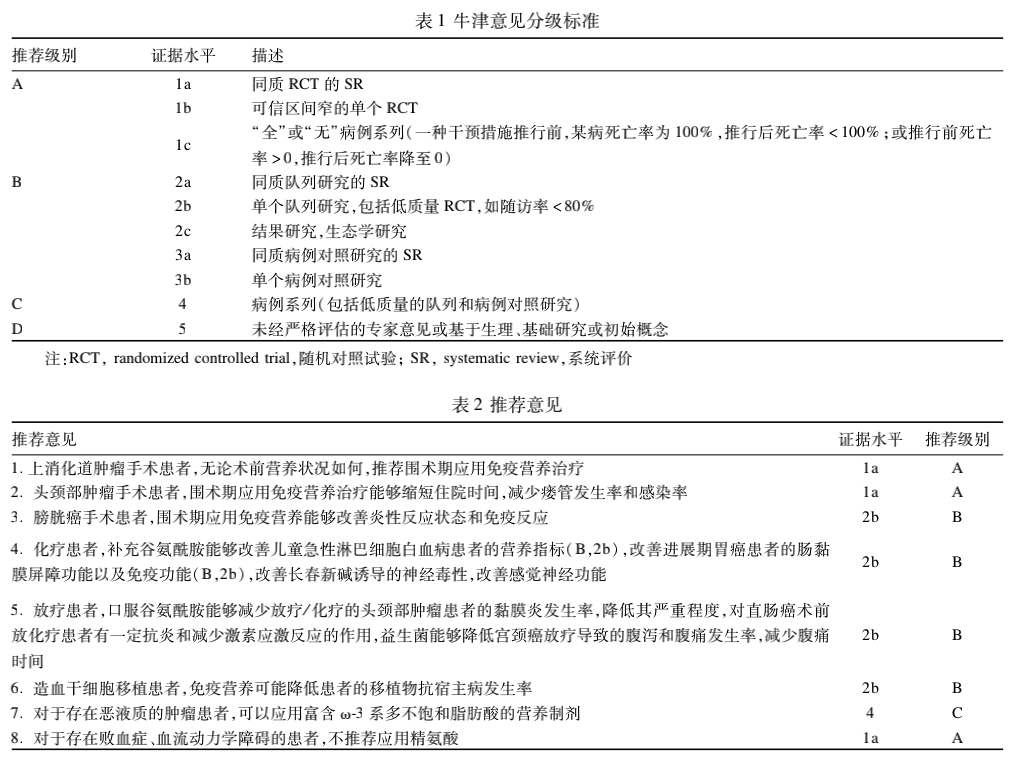
关键词:营养治疗指南;肿瘤免疫;免疫营养素;临床实践;循证医学证据一些特定的营养物质,不仅提供能量和营养底物、维持机体氮平衡和组织器官结构与功能,还具有调控应激状态下的机体代谢过程、炎性介质的产生和释放过程,以及刺激免疫细胞、增强免疫应答能力、维持肠道屏障功能和抗氧化及直接抗肿瘤作用,从而改善患者的临床结局。这些营养物质即免疫营养素,主要包括氨基酸、脂肪酸、核苷酸、维生素、微量元素、益生菌和益生元等。1992年Daly JM等[1]对上消化道肿瘤患者术后应用含精氨酸、ω-3脂肪酸及核苷酸的免疫营养配方,发现应用免疫营养治疗的患者,其损伤及炎性并发症发生更少,淋巴细胞有丝分裂恢复更快。在此之后关于肿瘤患者应用免疫营养治疗的研究不断涌现,涉及肿瘤患者的手术、放化疗及造血干细胞移植、恶液质治疗等多个方面,即形成了肿瘤营养学的一个重要分支---肿瘤免疫营养(cancer immunonutrition),并展现出了广阔的应用前景。营养不良、代谢异常、免疫失衡及炎性反应贯穿肿瘤发生、发展的整个病程。手术、麻醉等创伤可导致肿瘤患者多种激素和细胞因子分泌失调,引起炎性反应综合征等炎性反应,以及各种免疫细胞功能失调;放疗会影响肿瘤局部和肿瘤周围正常组织的功能,如头颈部肿瘤放疗会影响进食并造成黏膜炎等不良反应,盆腔放疗会引起肠道黏膜免疫屏障破坏、菌群失调等并发症,进而导致营养不良、黏膜免疫力下降、肠道菌群紊乱及局部炎性反应;化疗在杀伤肿瘤细胞的同时对机体的正常细胞也有损伤,影响患者的食欲及食物摄入,导致营养不良、免疫细胞比例失调等。免疫营养可以针对营养不良、代谢异常、免疫失衡及炎性反应等几个方面,改善肿瘤患者的营养、代谢和免疫状态,抑制炎性反应,切断上述因素互相促进的恶性循环。消化道肿瘤患者易发生营养不良,手术无疑会加重其营养不良,影响其预后。免疫营养治疗在胃肠道肿瘤限期手术的患者中研究最多,各种指南对于此类患者的推荐及建议也最丰富。多篇系统回顾及荟萃分析以随机对照试验(randomized controlled trial,RCT)为依据对数据进行整合、分析,为胃肠道肿瘤患者围术期推荐应用免疫营养提供了高水平的证据支持。但是,目前免疫营养对患者生存时间、生活质量等影响的研究仍多局限于术后短期阶段,其对患者长期生存的影响尚缺乏数据支持。免疫营养的有效性:2010年一项纳入21项研究,共1918例患者的系统评价表明免疫营养能显著减少择期手术患者感染和伤口并发症的发生率,并且缩短住院时间,但免疫营养组与标准营养组术后死亡率都是1%,差异无统计学意义[2]。另一项荟萃分析和系统评价得出了相似的结果[3]。免疫营养的术前应用:2017年Scarpa等[4]发表了一项关于术前应用免疫营养治疗对食管癌患者免疫监视功能影响的研究,对比两组手术获取的正常食管黏膜样本,发现与无特殊营养补充组相比,免疫营养治疗组白细胞分化抗原-80(cluster of differentiation 80,CD80)及CD80(抗原提呈细胞活化标志物)、髓样分化因子(myeloid differentiation factor 88,MyD88,固有免疫标志物)及CD69(细胞毒性淋巴细胞浸润和活化标志物)的信使RNA(messnger RNA,mRNA)水平显著升高,CD8+T细胞及CD107+自然杀伤细胞(natural killer cell,NK)显著增多;Peker KD等[5]通过研究术前应用免疫营养对胃癌组织肿瘤浸润T淋巴细胞和血管生成指标的影响,发现尽管与标准营养组相比,免疫营养组CD4+/CD8+T细胞比例下降(P<0.01),提示免疫营养治疗能够调节Th1细胞与Th2细胞(辅助性T细胞,helper T cell)的平衡,进而延长生存期,但同时CD105,表达升高(P=0.01),可能与肿瘤转移和短生存期相关,该研究指出需更大样本量的研究明确患者长期生存情况。2019年Russell K等[6]研究了术前应用免疫营养对绝大多数营养状态良好的行肝脏切除的肝癌患者炎性反应指标等的影响,发现免疫营养组患者(17例)二十碳五烯酸与二十二碳六烯酸的比值和与花生四烯酸的比值在术后1、3、5、7d均高于标准营养组(15例;P<0.05);术后7d免疫营养组患者血浆IL-6水平明显高于标准营养组(P=0.017);功能性指标、免疫反应(白细胞及总淋巴细胞计数)以及炎性反应指标[C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α)、IL-8、IL-10]在两组间无明显差异;免疫营养组10例发生感染并发症,标准营养组4例发生感染并发症(P=0.087);免疫营养与对照组的中位住院时间分别是,9d和8d,故免疫营养在营养状态良好的肝脏切除后的肝癌患者中未见明显获益。免疫营养的术后应用:2017年Luo Z等[7]报道了术后应用免疫营养治疗对胃肠肿瘤术后并发症、炎性反应及免疫指标影响的研究结果,相较于肠外营养组,免疫营养组患者在术后30d,有更短的住院日和更高的体质指数(P<0.05),但两组间总住院费用和短期术后并发症差异无统计学意义,免疫营养组患者外周血CD4+T细胞、NK、NK/T细胞及CD4+/CD8+T细胞比例显著上升,IL-2、干扰素-γ,分泌增多,TNF-α、IL-10分泌减少,细胞活化标志物CD27和CD28表达更高,无并发症生存期更长(P=0.04)。2018年最新的一项荟萃分析纳入了7项RCT,共583例胃肠道肿瘤患者,发现术后免疫营养应用多于7d组患者的淋巴细胞总数、CD4+T细胞、CD4+/CD8+T细胞比例增加,前白蛋白水平增加,然而上述指标在术后免疫营养应用时间<7d的患者中升高并不明显,应用免疫营养的患者全身炎性反应综合征以及术后并发症显著减少,提示长期免疫营养能改善细胞免疫、调节炎性反应、减少术后并发症[8]。2019年Li K等[9]进行了术后免疫营养治疗对胃切除的胃癌患者免疫功能、炎性反应和营养状态影响的研究,发现免疫营养组患者CD4+T细胞、CD3+T细胞、CD4+/CD8+T细胞比值、IgG、IgM和IgA水平显著高于对照组,同时白细胞、CRP和TNF-α的水平显著低于对照组,但营养指标没有变化,表明术后免疫营养能提高患者的免疫功能,改善炎性反应。值得注意的是,2018年Scislo L等[10]发表的一项纳入了98例胃癌患者的随机临床试验报道了胃癌患者术后肠内免疫营养对术后并发症和生存率的影响,结果表明,与标准肠内营养相比,术后予肠内免疫营养可减少呼吸系统并发症和术后病死率,但免疫营养组的6个月和1年生存率并没有提高。免疫营养的**应用时机:2019年McKay BP等[11]比较了因肝癌接受肝脏手术的患者术前和围术期接受免疫营养治疗的差别,在系统回顾中纳入了11个研究,共725例患者,发现一个队列研究显示在术前和围术期补充支链氨基酸能够减少全部并发症发生率26.9%,而另一个队列研究则显示术前免疫营养治疗能够减少术后腹水发生率25.4%,但不影响全部并发症发生率;4个研究表明免疫营养不能减少术后并发症的发生;术前和围术期给予支链氨基酸对术后病死率没有影响。Kanekiyov S等[12]于2019年发表了对围术期(术前7d到术后7d)应用免疫营养对行食管切除术的食管癌患者影响的研究结果,发现术后第1、7和14天免疫营养组患者的视黄醇结合蛋白水平显著高于对照组(分别为P=0.009、P=0.004、P=0.024);其术后感染并发症明显少于对照组(P=0.048);术后重症监护病房或住院时间在两组间无明显差异;免疫营养组和对照组5年无进展生存率分别为75%和64%(P=0.188),总生存率分别为68%和55%(P=0.187),结果表明围术期应用免疫营养治疗能够改善术后早期营养状况,减少术后感染并发症的发生。许多指南就消化道肿瘤患者营养治疗的持续应用时间及人群提出建议,推荐等级均较高,且近年的指南推荐更加确切,推荐级别较前有所提高:欧洲临床营养和代谢学会(Europran Society for Clinical Nutrition and Metabolism,ESPEN)指南认为,胃肠道大手术患者术前和术后应用包括精氨酸补充饮食在内的营养制剂,能明显降低术后感染率并缩短住院时间。2012年ESPEN[13]针对胰十二指肠切除术的患者,推荐在围术期5~7d应用口服免疫营养素,以减少术后感染并发症(证据级别:中;推荐级别:弱);针对存在营养不良风险的结肠手术患者,应考虑给予免疫营养治疗。应尽可能缩短术前禁食时间,术后应尽早开始正常进食,并可口服补充免疫营养制剂[14]。含有免疫营养素(精氨酸、谷氨酰胺、ω-3不饱和脂肪酸和核苷酸)的口服营养补充可使患者临床获益:减少术后并发症并缩短住院时间。ESPEN指南认为,虽然当时的研究结论存在一定的异质性,但对于营养不良的患者,免疫营养可能发挥更好的效果,所以指南仍推荐了免疫营养素的应用,但也指出其循证医学证据并不充分(证据级别:低;推荐级别:弱)。而2016年的ESPEN指南的更新版本中[15],对上消化道肿瘤患者,推荐在传统围术期应用口服=肠内免疫营养制剂(证据级别:高;推荐级别:强),指南认为虽然单一免疫营养素的作用尚不明确,但临床研究表明围术期应用免疫营养制剂能减少术后感染并发症,对于术后存在严重营养不良风险的上消化道肿瘤患者十分必要。2015年,中华医学会肠外肠内营养学分会(Chinese Society for Parenteral and Enteral Nutrition,CSPEN)指南指出:药理学剂量的鱼油脂肪乳剂,可用于结肠癌术后患者[16]。它能改善临床预后,包括减少血清IL-6、TNF-α水平,减少术后感染和全身炎性反应综合征发生,并缩短住院时间(A级证据)。推荐意见:上消化道肿瘤手术患者,无论术前营养状况如何,推荐围术期应用免疫营养治疗(A,1a)。2016年一项前瞻性队列研究,共纳入了195例高危头颈部肿瘤患者,与对照组相比,免疫营养组术后瘘管形成明显减少(P=0.007),住院时间平均缩短2.8d(P=0.02)[17]。2018年一项回顾性分析共纳入411例头颈部鳞状细胞癌患者,术前应用免疫营养制剂5d,发现与对照组相比,试验组住院时间显著缩短(6d vs 8d,P<0.001),局部感染率显著减少(7.4% vs 15.3%;P=0.006)[18]。此外,2019年一项针对接受手术治疗的头颈部肿瘤患者的回顾性研究发现,与对照组相比,术后接受富含精氨酸肠内营养的患者的瘘管发生率较低(17.91% vs 32.84%;P=0.047),并且平均住院时间较短[28.25(SD16.11) vs (SD25.73)d;P=0.030][19]。同年,有研究发现在复发性头颈部鳞状细胞癌的补救性手术中,术前免疫营养可以较好地控制并发症的发生率并缩短住院时间,这意味着免疫营养可能有助于改善这一高危人群的手术结果[20]。2006年ESPEN指南将颈部肿瘤手术患者围术期应用肠内免疫营养治疗作为A级推荐[21]。另外,Howes N等[22]根据Cochrane等数据库于2018年发表了一项纳入了19个随机对照试验(包括1099例参与者)的系统评价,评估了与标准喂养相比,免疫营养治疗对接受选择性头颈癌手术的成年患者术后恢复的影响,发现和对照组相比,免疫营养治疗虽然不能影响住院时间、伤口感染率和全因死亡率,但可降低术后瘘管形成的风险,其标准护理和免疫营养组瘘管形成的绝对风险分别为11.3%和5.4%,RR为0.48(95%CI=0.27~0.85)。推荐意见:头颈部肿瘤手术患者,围术期应用免疫营养治疗能够缩短住院时间,减少瘘管发生率和感染率(A,1a)2018年Hamilton-Reeves JM等[23]研究了围术期应用免疫营养制剂对根治性膀胱切除术患者免疫和炎性反应指标的影响,29例男性患者中有14例在术前及术后各接受5d免疫营养治疗,免疫营养组的Th1-Th2平衡,即TNF-α/IL-13的比值在术中较基线水平升高54.3%,而标准营养组降低4.8%,差异具有统计学意义(P=0.027);术后第2天免疫营养组外周血IL-6水平与标准营养组相比下降了42.8%(P=0.020);免疫营养组术后第2天血浆精氨酸仍维持在一定水平,而标准营养组与基线相比则下降了26.3%(P=0.0003),提示免疫营养能纠正Th1-Th2平衡,改善炎性反应,避免手术带来的精氨酸消耗。推荐意见:膀胱癌手术患者,围术期应用免疫营养能够改善炎性反应状态和免疫反应(B,2b)。2016年一项关于谷氨酰胺和转化生长因子β2是否能缓解胃肠道肿瘤患者化疗毒性的Ⅲ期临床试验表明,补充两种免疫营养物质并不能减少化疗引起的血液学和非血液学毒性[24]。同年一项针对谷氨酰胺对儿童急性淋巴细胞白血病化疗期间营养和免疫状态影响的RCT发现,与标准营养组相比,谷氨酰胺强化组患者身高、体重等指标未发生明显变化,但血浆前白蛋白、视黄醇结合蛋白、白蛋白、肱三头肌皮肤褶厚度等营养指标显著改善,水肿发生率显著减少(20.83%vs50%),CD3+T细胞、CD4+T细胞、CD4+/CD8+T细胞以及NK细胞比例显著增高[25]。2017年一项关于谷氨酰胺增强型营养对围化疗期的进展期胃癌患者肠黏膜屏障功能以及免疫功能影响的RCT中发现,与对照组相比,免疫增强组肠黏膜渗透程度相关指标更低"(尿中乳果糖/甘露醇比值,血中F>乳酸水平),肠黏膜损害程度指标更低[基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9],免疫功能改善(CD3+T细胞、CD4+T细胞、CD4+/CD8+T细胞水平更高,CD8+T细胞水平更低,抗体IgG、IgM、IgA水平更高),恶心呕吐、口腔黏膜炎、腹痛腹泻等化疗毒副作用发生率更低,生活质量有所提高[26]。2017年一项针对口服谷氨酰胺治疗儿童和青少年肿瘤患者长春新碱诱导的神经毒性的RCT中发现,补充谷氨酰胺能改善感觉神经功能,但对运动神经功能无明显改善[27]。2019年8月的一项研究指出,高纯度乳清蛋白有助于改善结直肠癌患者在化疗期间的营养状况,提示乳清蛋白可能是改善营养状况的重要治疗选择,特别是防止化疗期间的严重毒性[28]。2017年一项关于口服谷氨酰胺对放疗(或)化疗的头颈部肿瘤患者黏膜炎和皮炎影响的双盲RCT中发现,与安慰剂组相比,谷氨酰胺组黏膜炎发生率更低,但两组差异无统计学意义(P=0.324);而其黏膜炎的发生率显著减少(P=0.038),严重程度显著降低(P=0.032)[29]。2017年一项关于直肠癌患者术前新辅助放化疗过程中应用肠内谷氨酰胺治疗对其炎性反应和激素反应影响的RCT研究发现,与安慰剂组相比,谷氨酰胺组患者血浆IL-6水平更低(5.5±3.8ng/l vs 8.1±5.2ng/L,P=0.02),而谷氨酰胺组患者血浆皮质醇水平在接受谷氨酰胺后也显著降低(386.5±168.4nmol/L vs 312.7±111.7nmol/L;P=0.03),提示口服谷氨酰胺有一定抗炎作用,进而减少放化疗期间的激素应激反应。另外,2018年一项关于口服益生菌治疗宫颈癌放疗导致的腹泻的RCT发现,益生菌组较安慰剂组患者腹泻率显著降低,:级腹痛发生率显著减少,腹痛时间显著缩短[31]。对于接受放疗、化疗的患者,各指南推荐如下。2015年,欧洲肿瘤内科学协会(European Society for Medical Oncology,ESMO)与多国支持癌症护理协会/国际口腔肿瘤学会(Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology,MASCC/ISOO)指南均作出推荐:对于盆腔肿瘤化疗和(或)放疗的患者,建议使用含乳酸杆菌的益生菌预防患者腹泻(证据级别Ⅲ),对于接受放疗或放化疗的口腔癌患者,应用口服锌补充剂来预防口腔炎可能获益(证据级别Ⅲ)[32]。2016年美国营养与饮食学会(Academy of Nutrition and Dietetics,AND)指南[33]提出:对于肿瘤患者化疗诱导的周围神经炎,可考虑应用免疫营养素,如维生素E、钙、镁、乙酰左旋肉碱、谷氨酰胺、谷胱甘肽等。但它们的效果并不确切(推荐等级:弱;条件性的)。2016年ESPEN指南[15]肿瘤内科治疗,包括细胞毒治疗和靶向治疗,目前并没有充分的证据支持谷氨酰胺的应用(推荐强度:无,证据等级:低)。对于预防放疗诱导的肠炎(或)腹泻、胃炎、食管炎或皮肤毒性,不推荐应用谷氨酰胺(推荐强度:无,证据等级:低)。各指南对免疫营养在肿瘤放化疗中应用的推荐级别仍较低,但近年来相关研究不断增多,研究的主要营养素为谷氨酰胺,且其中许多结果显示谷氨酰胺改善免疫功能和抗炎的作用,这可能会影响各大指南的推荐级别。推荐意见:化疗患者,补充谷氨酰胺能够改善儿童急性淋巴细胞白血病患者的营养指标(B,2b),改善进展期胃癌患者的肠黏膜屏障功能以及免疫功能(B,2b),改善长春新碱诱导的神经毒性,改善感觉神经功能(B,2b)。推荐意见:放疗患者,口服谷氨酰胺能够降低放疗(或)化疗的头颈部肿瘤患者的黏膜炎发生率,降低其严重程度(B,2b),对直肠癌术前放化疗患者有一定抗炎和减少激素应激反应的作用(B,2b),益生菌能够降低宫颈癌放疗导致的腹泻和腹痛发生率,减少腹痛时间(B,2b)。造血干细胞移植患者应用免疫营养治疗的临床试验较少,证据尚存不足。Lyama S等[34]回顾性研究了在预处理前7d到造血干细胞移植后28d给予患者含有谷氨酰胺、纤维素和低聚糖的口服免疫营养制剂对并发症及短期生存等的影响,发现试验组患者的严重腹泻、黏膜炎持续时间明显缩短(0.86d vs 3.27d;3.86d vs 6.00d),体重丢失的天数也明显减少,100d的生存率显著提高(100% vs 77.3%;P=0.0091)。2017年一项纳入了10个RCT,共681例造血干细胞移植患者的荟萃分析发现,免疫营养治疗将移植物抗宿主病发生率降低了19%(RR=0.810,95%CI=0.695~0.945,P=0.007),然而试验组患者感染发生率并无显著降低[35]。对于造血干细胞移植的患者,肠外应用谷氨酰胺相比肠内应用更能改善负氮平衡、缩短住院时间、降低严重的黏膜炎和血液感染的发病率,故ASPEN指南对此推荐肠外应用药理剂量的谷氨酰胺(C级证据)[9]。ESPEN指南认为造血干细胞移植的患者可能从谷氨酰胺强化的肠外营养中获益(B级证据)[36]。2016年ESMO指南对接受造血干细胞移植的肿瘤患者,无论是否进行全身照射,应用静脉注射谷氨酰胺以预防接受大剂量化疗患者的口腔黏膜炎(证据级别Ⅱ)。这方面,最新呈现的研究是2019年韩国发表的一项纳入了91例患者的回顾性分析评估了含谷氨酰胺的肠外营养对造血干细胞移植患者临床结局的影响,结果表明,谷氨酰胺组与非谷氨酰胺组相比,临床感染率和100d死亡率均较低,多变量分析显示谷氨酰胺组临床感染和100d死亡率的优势比分别为0.37(95%CI=0.14~0.96,P=0.042)和0.08(95%CI=0.01~0.98,P=0.048)[37]。推荐意见:造血干细胞移植患者,免疫营养可能降低患者的移植物抗宿主病发生率(B,2b)。2017年一项针对进展期胃肠道肿瘤恶液质患者骨骼肌减少的回顾性研究发现,腰大肌指数变化率(psoas major index,△PMI),肌肉减少症指标1降低组与升高组比较,其ω-6/ω-3比值与花生四烯酸/二十碳五烯酸(AA/EPA)比值均显著升高,血清EPA水平和△PMI)呈正相关(CC=0.443,P=0.039),血清CRP,AA/EPA比值及ω-6/ω-3比值和△PMI负相关(CC=-0.566,P=0.006;CC=-0.501,P=0.018;CC=-0.476,P=0.025),因此血清AA/EPA比值及ω-6/ω-3比值升高,分别为5.73和3.96,可能作为肌肉减少症的诊断指标,并与预后不良相关[38]。同年另一项回顾性研究针对存在恶液质的胃肠道肿瘤患者,观察化疗同时加用富含ω-3系多不饱和脂肪酸(含EPA)的营养治疗后,患者炎性反应指标及体组织等的变化情况,发现对照组血浆CRP水平显著升高,而骨骼肌量和瘦体组织没有明显变化,相反,ω-3系多不饱和脂肪酸组血浆CRP水平未见变化,而骨骼肌量和瘦体重随着时间显著增加;并且血清高CRP水平与化疗耐受性减弱相关,富含ω-3系多不饱和脂肪酸的营养补充能提高化疗耐受性,改善恶液质状态,改善预后[39]。指南对肿瘤患者恶液质状态的免疫营养治疗推荐强度和级别都非常低,不论是早年和近期的证据都很少,不足以支撑临床推荐。2016年,EPCRC更新临床指南时进一步强调,虽然在某些研究中发现了它们的某些益处,例如β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate,HMB)、精氨酸和谷氨酰胺联合应用4周后能增加肺癌患者瘦体组织等。但仍没有足够的证据推荐在恶液质肿瘤患者中应用这些营养素[40]。2016年ESPEN指南指出,对于接受化疗且存在体重丢失和营养不良风险的进展期肿瘤患者,建议应用含长链ω-3脂肪酸或鱼油的营养添加剂,以稳定或改善食欲、食物摄入、瘦体组织和体重(推荐强度:弱,证据强度:低)[15]。此外,对接受抗肿瘤治疗的全身炎性反应和恶液质的晚期肿瘤患者,支链或其他氨基酸或其代谢产物,包括HMB、精氨酸和谷氨酰胺能否被推荐应用于改善体重下降,目前尚无充分的临床证据(推荐强度:无,证据水平:低)。恶液质状态常伴系统性炎性反应,对此,2015年日本肠外肠内营养学会指南指出,可推荐尝试应用所谓特殊药物疗法(特殊药物物疗法),其包括不饱和脂肪酸(EPA等)在内的免疫营养素,可通过下调NF-KB(核因子激活的B细胞的K-轻链增强nuclear factor-kβ活性、抑制炎性反应性细胞因子等机制以拮抗系统性炎性反应,从而让患者获益[41]。推荐意见:对于存在恶液质的肿瘤患者,可以应用富含ω-3系多不饱和脂肪酸的营养制剂(C,4)。败血症患者常存在血流动力学不稳定的情况,L-精氨酸被认为会在体内代谢产生一氧化氮,加重败血症患者的血管扩张,导致败血症血流动力学更加不稳定。对于败血症、血流动力学障碍的患者不推荐应用含有精氨酸的肿瘤免疫营养。在此方面各指南的推荐意见不一致,如ESPEN指南[42]、重症监护医学协会(Society of Critical Care Medicine,SCCM)和ASPEN指南[43]支持轻到中度败血症患者应用精氨酸,不推荐重度败血症患者应用,而加拿大临床实践指南(Canadian clinical practice guidelines,CCPG)则认为精氨酸不能应用于败血症患者[44]。推荐意见:对于存在败血症、血流动力学障碍的患者,不推荐应用精氨酸(A,1a)。本指南采用牛津循证医学中心(Oxford Centre for Evidence-based Medicine,OCEBM)意见分级标准,具体推荐级别、证据水平,见表1和表2。